Erik Abner
Tartu Ülikooli ja Genoomika Instituudi funktsionaalse genoomika teadur
Vaktsiinide loomisest räägib emotsioonidevabalt ja teaduslikult geneetik Erik Abner. Allpool jagame lugemiseks Abneri pikemat ülevaadet vaktsiinide loomisest, keskendudes vaktsiinide tehnilistele aspektidele.
Abneri taustaks on kliiniline molekulaarbioloogia ja geneetika. Varasem töö- ja õpikogemus on keskendunud viirustele, viimasel kahel aastal inimgeneetikale Geenivaramus.
Üks sagedamini küsitavaid küsimusi, millele vastama olen pidanud, on põhiliselt suunatud mRNA vaktsiinide kohta, mis on turul uued tegijad ja millest keskmine inimene varasemalt palju tõenäoliselt kuulnud pole:
Kuidas on võimalik, et need vaktsiinid tehti ühe aastaga valmis?
Lühikest ja lihtsat vastust sellele küsimusele otseselt ei ole, aga kokkuvõtvalt mõjutasid sellist teadussaavutust:
– uued tehnilised oskused;
– varasemad kogemused vaktsiinide arendamisel;
– aastakümnete jooksul kogunenud teadmised koroonaviiruste kohta;
– avalik huvi ja suur hulk vabatahtlikke uuringutes osalejaid;
– haiguse enda olemus;
– bürokraatia vähenemine;
– astronoomiline hunnik raha.
Seega kindlasti ei ehitatud neid vaktsiine nullist üles; nende arendamisse läks sisse hulgaliselt rohkem aastaid tööd. Märkimisväärne hulk ühiskondlikku tahtejõudu aitas neid arenguid läbi suruda.
Keskenduksin selles atiklis vaktsiinide tehnilistele aspektidele, sest molekulaarbioloogina näen ma nendes uutes vaktsiinides fantastiliselt huvitavaid nüansse, mis kinnitavad alusteaduste tähtsust tänapäevases maailmas.
mRNA taust ja varasem kasutus
RNA on molekul, mida meie keha sarnaselt DNA-le ja valkudele kasutab hulgaliste biokeemiliste protsesside läbiviimiseks. Oma olemuselt pole RNA midagi maagilist, seda on absoluutselt kõik elusolendid siin planeedil juba miljardeid aastaid tarvitanud. Ka inimkehas pole RNA miskit võõrast – näiteks on meie kehas RNA-d isegi rohkem kui DNA-d. mRNA on RNA molekulide alaliik (messenger RNA), mis kannavad edasi geneetilist informatsiooni ning selle info põhjal ehitatakse üles uusi valke. Sisuliselt on tegu kokandusretseptiga – ta annab juhiseid kuidas teha miskit asjalikku. mRNA vaktsiinide puhul anname me inimese rakkudele juhendi, kuidas toota ühte viirusevalku (ogavalku), mida siis meie immuunsüsteem kasutab viiruse vastu treenimiseks ära.
1989 tõestasid California teadlased esimest korda, et me suudame laborirakkudesse mRNA-d sisse viia niiviisi, et sellelt ka uusi valke toodetakse. See avas meie meditsiiniteadustele hulgaliselt uusi uksi, sest sellist tehnoloogiat saaks kasutada mitte ainult nakkushaiguste vastu, vaid ka näiteks vähi ravimiseks. Kui me võtaksime inimest painavast vähist valgulise ja geneetilise proovi, siis tõenäoliselt suudaksime leida sealt mõne unikaalse ning muteerunud valgu, millega me saaks enda immuunsüsteemi ohtliku vähi vastu treenida.
Aga! -Oh häda! Me ei osanud tollal seda mRNA molekuli organismis õigetesse rakkudesse sisse viia, seega ei suutnud teadlased tulla lagedale ühegi töötava RNA-põhise teraapiaga (see on siiani suur takistus). Ühtlasi vaevas RNA-teadust ka üks veel suurem bioloogiline probleem – nimelt kasutavad RNA-d ka paljud meie organismi ründavad viirused, seega on meil arenenud sadade miljonite aastate jooksul välja väga tõhus kaitse kõikide võõraste RNA molekulide vastu.
Tehnilised nüansid
Ja siin tulevadki mängu need väikesed tehnilised nüansid, millest ma lubasin rääkida. Keskendun siin kolmele sellisele aspektile:
Punkt 1 – nähtamatuks jäämine
Vaktsiinide mRNA peab meie keha viirusevastaste immuunvalkude eest nähtamatuks jääma. Selleks kasutatakse mRNA vaktsiinides (Modernas ja Pfizeris) n.ö modifitseeritud RNA-d.
Nagu ka DNA puhul, koosneb RNA nukleotiididest ehk siis nendest kemikaalidest mida kirjutatakse lühenditega A, C, G ja U (uratsiil). RNA modifitseerimise puhul muudetakse seal uratsiili keemilist struktuuri natukene. Täpselt nii palju, et meie keha immuunsüsteem seda enam aktiivselt ei ründaks, aga et mRNA ise veel aktiivsena toimiks ning et sellelt saaks valgujärjestuse välja veel lugeda. Ka siin ei ole tegelikult tegemist teadlaste omavolilisega leiutisega – meie enda rakud kasutavad meie oma enda RNA modifitseerimist sarnaselt ära, et immuunsüsteemi „raevu“ vältida. Seega kasutavad Pfizeri ja Moderna mRNA molekulid meie kehas juba olemasolevat mehhanismi lihtsalt ära. Seda tüüpi RNA modifitseerimistest oleme me juba aastakümneid teadlikud olnud ning 2005 aastal suudeti laborirakkudel ka näidata, et me saame sellist modifitseerimist ilma immuunsüsteemi ärritamata ära kasutada. Vägagi võimalik, et selle eest saavad töö autorid kunagi ka Nobeli preemia (Viide: Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA).
Modifitseeritud RNA kasutamine tagab, et vaktsiinide mRNA ei lagundata meie kehas mitte esimeste tundidega ära, vaid et meie rakud saaksid seda mõningaid päevi kasutada.
Fun fact: Moderna nimi tuleb modifitseeritud RNA (modRNA) välja-hääldamisest.
Moderna firma alustas tööd aastal 2010, keskendudes just modifitseeritud RNA (modRNA) uuringutele.
Punkt 2: pikem eluiga
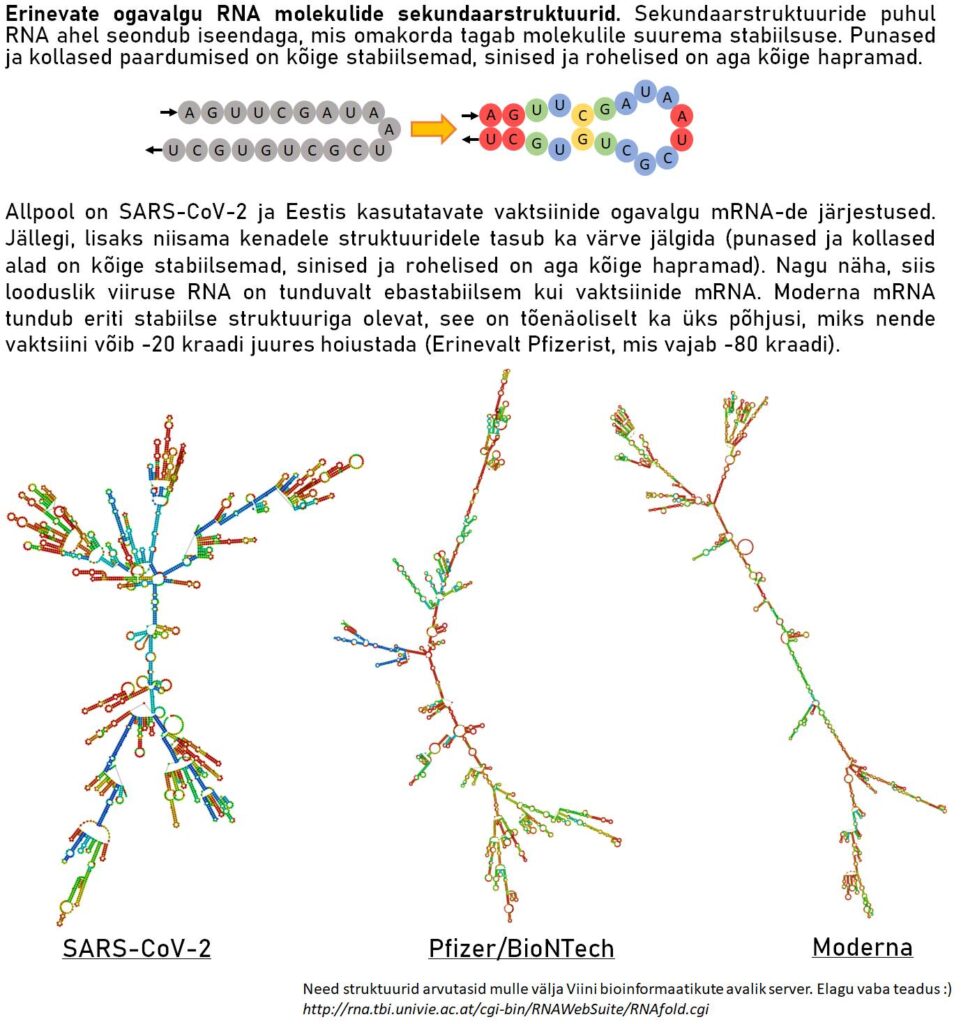
Lisaks RNA modifitseerimisele muudeti ka natuke RNA järjestust ennast. Kui me vaatame loodusliku viiruse ogavalgu järjestust, siis seal on 37% G/C ja 63% A/U nukleotiidid. Kuid Pfizeri vaktsiin tõstab selle suhte 56% G/C ja 44% A/U peale. Moderna koguni 61% G/C ja 39% A/U peale. Kusjuures nende GC muudatustega ei muudeta ogavalgu struktuuri, sest geneetiline kood säilitatakse.
– Miks seda siis tehakse?
Põhjus peitub jällegi inimrakkude bioloogias. Nimelt on teadlased varem avastanud, et mida suurem on A ja U nukleotiidide osakaal mõnes RNA molekulis, seda kiiremini sellist RNA-d rakus lagundatakse. Kuna kõrge GC-sisaldusega mRNA eluiga on pikem, siis toodetakse selle pealt ka rohkem valke. Ühtlasi on mRNA vaktsiine disaininud teadlased vältinud ka teatud spetsiifilisi mRNA järjestuste kombinatsoone (koodoneid), mida inimrakkudes varasemate teadusuuringute põhjal harvemini esineb. Niiviisi toimib mRNA pealt valkude tootmine võimalikult kiiresti, sest kasutatakse rakus ainult kõige sagedamini esinevaid ehitusklotse. Sellise optimiseerimise tagajärjel toimib vaktsiini mRNA veelgi efektiivsemalt võrreldes loodusliku viiruse RNA-ga. Peab ära ka mainima, et kõrgem GC nukleotiidide osakaal muudab ka RNA enda stabiilsemaks. Näiteks on Moderna mRNA järjestus ~4080 nukleotiidi pikk. Kui see mRNA jupike nüüd kaootiliselt spagetina ringi ujuks, siis kindlasti lagundataks ta kiiremini ära. Kuid kõrge GC sisaldus (G ja C nukleotiidid seonduvad üksteiseiga tugevamini kui A ja U) lubab sellel pikal molekulijupil iseendaga seoseid luua. Niiviisi luuakse stabiilsemaid kolmemõõtmelisi sekundaarstruktuure, mis kindlasti jällegi pikendavad vaktsiini toimeainet (vaata joonist).
Kõik see koodonite teaduse, mRNA stabiilsuse ja RNA-sekundaarstruktuuride teema on jällegi kümnete tuhandete varasemate teadustööde jooksul higi ja vaevaga kokku kogutud info.
Punkt 3: mutatsioonid
Molekulaarbioloogias on valkude struktuuril tähtis roll. Kui viiruse RNA pealt toodetakse lõpuks üks ogavalk, siis see pakitakse oma õigesse asendisse kokku ning suunatakse uue viirusosakese pinnale. Seal viiruse pinnal haagitakse uus ogavalk viiruse kesta külge. Kuid mis juhtub, kui ogavalku pole millessegi haakida? Vaktsiinide tagajärjel toodetakse ju ainult ogavalke ennast, ülejäänud viirust sealt kokku ei ehitata. Tuleb välja, et selline „mitte-haagitud“ ogavalk ei tööta väga hästi.
Aastal 2017 uurisid USA teadlased SARS-CoV-2 sugulast MERS-i ning üritasid selle vastu vaktsiini disainida. Väga suur hulk meie tänaseid teadmisi koroonaviiruste kohta pärinevadki MERS-ilt, kuna ta on teadaolevalt kõige surmavam koroonaviirus ning kuna ta siiamaani veel vaikselt Euraasias levib. Uuringute käigus avastati, et kuna MERS-i vaktsiinide poolt toodetud ogavalgud ei saa ennast kuhugi kinnitada, siis nad lihtsalt lagunevad laiali. Seega viidi ogavalgu järjestusse sisse kaks väikest mutatsiooni, mis aitasid ogavalkudel ka ilma kuhugi kinnitumata koos püsida. Kui 2019 aastal maailma SARS-CoV-2 ründas, siis viidi kibekähku sarnased kleepeka-mutatsioonid ka uutele SARS-CoV-2 vaktsiinide ogavalkude järjestustesse sisse. Kuna MERS-i ja SARS-CoV-2 ogavalgu struktuurid on piisavalt sarnased, siis sai teadusmaailm ilma suurema vaevata kasutada ära varasemaid teadmisi teise viiruse kohta. Täna kasutavad neid mutatsioone (mutatsioonid K986P ja V987P; kutsutakse ka 2PP mutatsioonideks) Pfizer ja Moderna, AstraZeneca on kuidagi ilma 2PP-ta oma vaktsiini saanud tööle.
AstraZenecast rääkides: 2019 aastal sai AZ valmis MERS-i vaktsiiniga, mida nad ka aasta lõpus inimeste peal katsetama hakkasid. Kui tuli uudis uue SARS-CoV-2 viiruse kohta, siis tuli AZ teadlastel lihtsalt natuke seal vaktsiinis ogavalgu järjestust muuta ja oligi uus vaktsiin testimisvalmis. See on lisa-põhjus, kuidas ka üks mitte-mRNA vaktsiin nii kiiresti turule sai tulla.
Tuli pikk ja keeruline jutt aga ma loodan, et see annab lugejale aimu, kui kaugele on meie teadmised arenenud. Kui meid oleks 10-20 aastat tagasi niivõrd raske pandeemia tabanud, siis me poleks niivõrd tõhusate vaktsiinidega nii kiiresti välja suutnud tulla.
Kes teab, mis arenguid ja võidulugusid molekulaarbioloogia järgmiste aastakümnete jooksul meile toob?
Ja muidugi – kui on lisaküsimusi, siis leian aega ka nendele vastamiseks!
Erikule saab kirjutada näiteks Facebooki-kontole. Tema seinalt leiab ka mitmeid muid avalikke aruteluteemasid seoses SARS-CoV-2 viirusega: Erik Abner
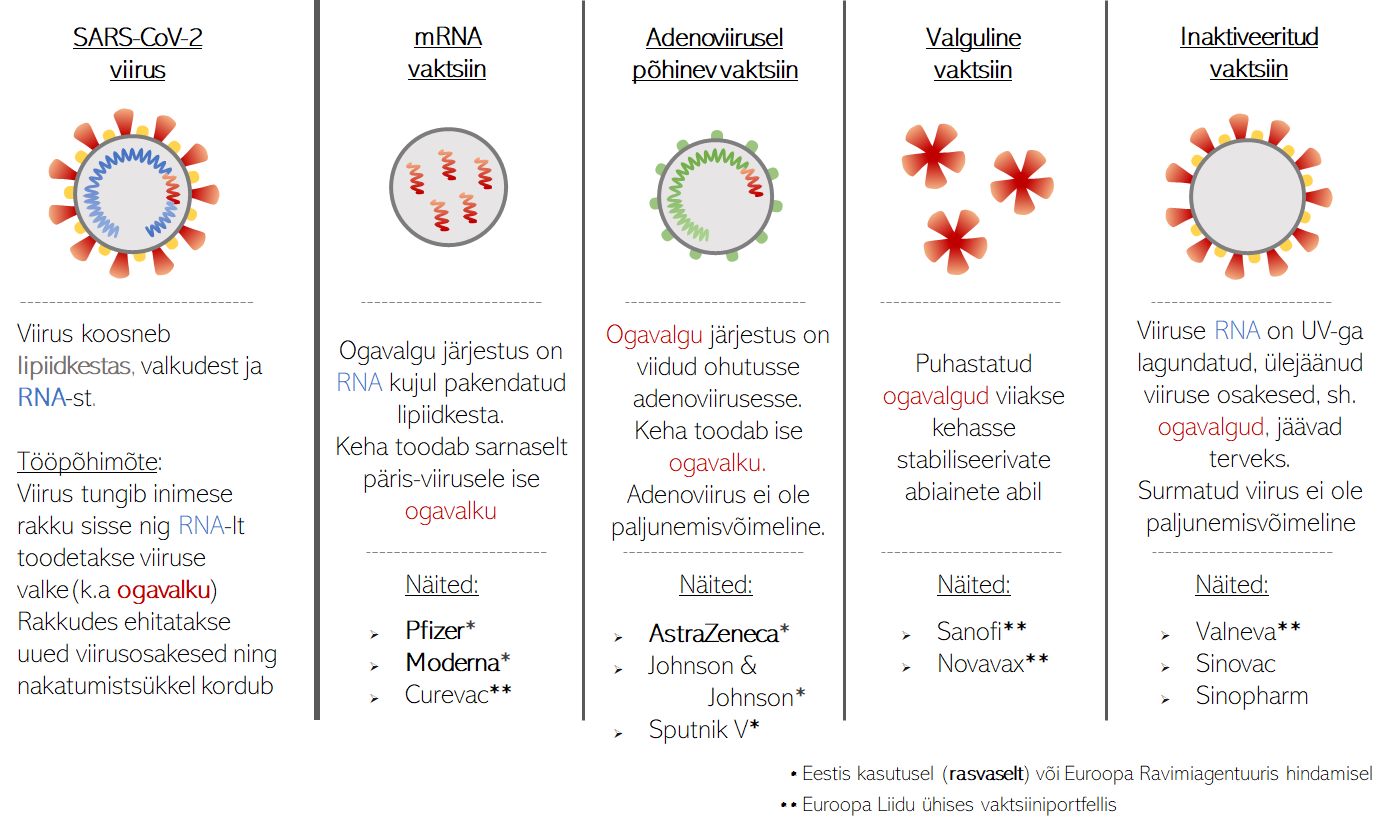
Päise pilt: Erinevate vaktsiinide kirjeldamise tabel. Autor: Erik Abner